En el estado gaseoso, la vibración de las moléculas es lo suficientemente fuerte como para vencer a las fuerzas intermoleculares. Las moléculas (o átomos, como en el caso de los gases nobles) están completamente sueltas.
Al igual que el estado líquido, el estado gaseoso también se considera un fluido (ya que puede fluir por una tubería).
Las partículas de un gas siguen trayectorias rectas y se mueven a grandes velocidades (entorno a 1000 Km/h). La velocidad aumenta con la temperatura y disminuye con la masa atómica o molecular. Esto hace que los gases tiendan a ocupar el máximo volumen posible, lo que explica lo que pasa si echamos ambientador en una habitación cerrada (al cabo de un tiempo, toda la habitación huele, ya que las partículas del ambientador tienden a ocupar todo el volumen posible, toda la habitación).
En el caso de estar el gas contenido en un recipiente, las partículas chocan con las paredes del recipiente, generando una presión.
Supongamos que cogemos un émbolo, lleno de un gas. Inicialmente, ocupa un volumen, supongamos 1L.
¿Qué pasa si aumenta la temperatura? Las partículas vibran más rápidamente, chocan con más fuerza contra el émbolo, haciendo que el émbolo suba, aumentando el volumen.Temperatura y volumen son directamente proporcionales.
¿Qué pasa si aumenta la presión que ejerce el émbolo sobre el gas? Las partículas están más unidas, disminuyendo el volumen. Presión y volumen son inversamente proporcionales.
El aire es una mezcla de gases, con una proporción fija: 78% de N2, 21% de O2 y 0'9% de Ar.
Veremos un resumen de unas cuantas leyes de los gases, con un ejemplo de cada una:
LEY DE AVOGADRO (a P = cte y T = cte)
[1] Tenemos 10 gramos de Ne (0'5 moles) que ocupan un volumen de 0'4 L. Extraemos 2 gramos (0'1 moles). Teniendo en cuenta que no variamos ni la presión ni la temperatura. ¿Cuál es el nuevo volumen?
V1 = 0'4 L
n1 = 0'5 moles
¿V2?
n2 = 0'1 moles
0'4 L V2
______ = ______
0'5 mol 0'1 mol
V2 = 0'08 L (como hemos quitado gas, disminuye el volumen)
LEY DE BOYLE (a T = cte)
[2] A nivel del mar (P = 760 mmHg), un gas ocupa 3L. En lo alto del Mulhacén (P = 513 mmHg), suponiendo la misma temperatura, ¿qué volumen ocupará el gas?
P1 = 760 mmHg
V1 = 3 L
P2 = 513 mmHg
¿V2?
760 mmHg · 3 L = 513 mmHg · V2
V2 = 4'44 L (al haber menos presión externa, el gas se expande más)
LEY DE CHARLES (a P = cte)
[3] En una ciudad, en invierno, hace 13 º C (286 K). Un determinado gas ocupa 5 L. En verano, hace 27 º C (300 K). ¿Cuál es el nuevo volumen?
V1 = 5 L
T1 = 286 K
¿V2?
T2 = 300 K
5 L V2
______ = ______
286 K 300 K
V2 = 5'24 L (al aumenta la temperatura, el gas se dilata y aumenta el volumen)
LEY DE GAY - LUSSAC (a V = cte)
[4] Una botella puede soportar una presión máxima de 2000 mmHg. A 34 º C (307 K), un gas encerrado en esa botella ejerce una presión de 800 mmHg. La botella se calienta. ¿A qué temperatura explotará?
P1 = 800 mmHg
T1 = 307 K
P2 = 2000 mmHg
¿T2?
800 mmHg 2000 mmHg
__________ = __________
307 K T2
T2 = 767'5 K (494'5 ºC)
Un proceso a T = cte es isotérmico
Un proceso a P = cte es isobárico
Un proceso a V = cte es isocórico
Vistas quedan. La utilidad práctica de estas leyes es mínima. Solo recomiendo saber aplicarlas y medio entenderlas, nada de fórmulas ni mucho menos enunciados. Ahora bien, con todas estas leyes podemos llegar a la ecuación de estado de los gases ideales, la verdaderamente importante.
ECUACIÓN DE ESTADO DE LOS GASES IDEALES
P · V = n · R · T
Siendo:
P = presión (en atmósferas)
V = volumen (en litros)
n = moles
R = 0'082 (atm · L / mol · K)
T = temperatura (en kelvin)
Pasar de ºC a K: K = ºC + 273
Pasar de mmHg a atm: atm = mmHg / 760
CONDICIONES NORMALES, P = 1 atm, T = 273 K
CONDICIONES ESTÁNDAR, P = 1 atm, T = 298 K
[5] Tenemos una botella de 5 L de Cl2, a 20 º C y 700 mmHg. ¿Cuántos gramos de Cl2 tenemos?
Lo primero es pasar todo a las unidades de la ecuación:
T = 20 + 273 = 293 K
P = 700/760 = 0'921 atm
Ahora, localizamos la incógnita. ¿Qué tenemos que calcular? La masa de cloro, pero la masa no aparece en la ecuación. Sí aparece moles, y pasar a masa a moles es muy fácil. Luego la incógnita son los moles, n:
0'921 atm · 5 L = n · 0'082 · 293 K
n = 0'19166 moles
masa = moles · masa molecular = 0'19166 mol · 71 g/mol = 13'6 gramos
[6] Tenemos una botella de 5L de Cl2, en condiciones normales. ¿Cuántos gramos de Cl2 tenemos?
Por definición, sabemos que condiciones normales son:
T = 273 K
P = 1 atm
La incógnita sigue siendo los moles, n:
1 atm · 5 L = n · 0'082 · 273 K
n = 0'22335 moles
masa = 0'22335 moles · 71 g/mol = 15'85 gramos
[7] Halla la densidad del oxígeno (O2) en condiciones estándar.
Este ejercicio es un poco más complicado que los anteriores. Primero, ¿qué nos piden? La densidad, que se define como:
m
d = _____
v
Podemos despejar el volumen:
m
v = _____
d
Y sustituirlo en la ecuación de los gases ideales:
P · m = n · R · T
__
d
Ahora sabemos que:
m
n = ____
mm → masa molar
Sustituímos en la ecuación:
P · m = m · R · T
___ ___
d mm
Quitamos "m":
P = R · T
_ ____
d mm
Despejamos la densidad:
P · mm
d = ________
R · T
Esta es la fórmula que vamos a utilizar para hallar la densidad. Si nos fijamos, solo depende de la masa atómica o molecular, la presión y la temperatura (R es constante). En este caso:
P = 1 atm
mm = 32 g/mol
T = 298 K
1 atm ·32 g/mol
d = ______________ = 1'31 g/L
0'082 · 298 K
Debemos distinguir gases ideales de gases reales. Al trabajar con gases ideales, despreciamos efectos como el volumen que ocupa las partículas del gas y las repulsiones que puede haber entre estas. Es una simplificación con la que cometemos muy poco error. Trabajamos con gases reales cuando no hacemos esta simplificación. Hasta no llegar a la universidad, esta simplificación es válida. De todas formas, la diferencia se aplicará en un ejercicio.
ALGUNOS EJERCICIOS PARA PRACTICAR

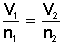
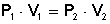
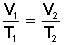
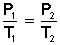
No hay comentarios:
Publicar un comentario