Una reacción química es el proceso en el que unos reactivos se combinan, cambiando sus estructuras y enlaces para dar unos productos. A la representación de ese cambio se le denomina ecuación química. Por ejemplo:
2A (s) + 3B (aq) → C (g) + 4D (l)
Esta ecuación química representa una reacción química.
Lo que hay a la izquierda de la flecha son los reactivos.
Lo que hay a la derecha son los productos.
Los números indican cuántas átomos o moléculas se necesitan. También cuántos moles se necesitan.
Lo que hay entre paréntesis indica el estado en el que se encuentra ese reactivo o producto:
(s) = sólido
(l) = líquido
(g) = gaseoso
(aq) = acuoso
Este último estado a penas lo vamos a ver en Química Básica. Un ejemplo de este sería añadir sal en agua. La sal de disuelve, la sal para a estado acuoso.
Un ejemplo menos genérico de ecuación química, la que representa a la reacción de combustión del octano (componente principal de la gasolina):
¿Qué información nos aporta?
- El octano debe estar líquido (la gasolina es líquida)
- El oxígeno debe estar en estado gas
- Se produce dióxido de carbono gaseoso y agua líquida.
- 1 molécula de octano se une a 25/2 moléculas de oxígeno para dar 8 moléculas de dióxido de carbono y 9 moléculas de agua
- 1 mol de octano se une a 25/2 moles de oxígeno para dar 8 moles de dióxido de carbono y 9 moles de agua.
En esta caso, para no tener que trabajar con fracciones, podemos multiplicar toda la ecuación por 2, obteniendo una ecuación equivalente:
2C8H18 + 25O2 → 16CO2 + 18H2O
A veces, podemos encontrarnos encima de la flecha Δ o "hv". El primer símbolo indica que la reacción necesita un aporte de energía para empezar, el segundo, que necesita luz. Por ejemplo, la ecuación que representa la reacción generaliza de la fotosíntesis:
Algo que tenemos que tener en cuenta en una reacción es el Ley de conservación de la materia (o Ley de Lavoisier). La materia no se crea ni se destruye, solo se tranforma:
masa de los reactivos = masa de los productos
Esto no se cumple en reacciones nucleares.
[1] En una reaccion del tipo A + B → C + D, se hacer reaccionar 10 gramos de A y 15 gramos de B, obtenemos 20 de C. ¿Cuántos se obtienen de D?
Aplicamos la Ley de Lavoisier:
masa de los reactivos = masa de los productos
mA + mB = mC + mD
10g + 15g = 20g +mD
mD = 5 gramos
Veamos otro ejemplo de ecuación química:
3H2 + N2 → 2NH3 [reacción de síntesis del amoniaco]
¿Cómo se conserva la materia?
En los reactivos tenemos 6 átomos de hidrógeno y 2 átomos de nitrógeno.
En los productos tenemos 2 átomos de nitrógeno y 6 átomos de hidrógeno.
Se puede decir que en el paso de reactivos a productos, "no se pierde ningún átomo".
Si no se cumple esto, las reacciones se deben ajustar. El ajuste de reacciones, a este nivel, se puede hacer por dos métodos: tanteo o algebraico.
[2] Se tiene la reacción H2 + O2 → H2O
(a) ¿Está ajustada?
En los reactivos tenemos 2 átomos de hidrógeno y 2 átomos de oxígeno.
En los productos tenemos 2 átomos de hidrógeno y 1 átomo de oxígeno.
Luego, no está ajustada.
(b) Ajústala por el método del tanteo
El tanteo es un método difícil, ya que requiere mucha práctica. Este caso es de los fáciles. Del apartado (a) sacamos que nos falta 1 átomo de oxígeno en los reactivos para estar ajustada. ¿Cómo hacemos para tener 2 átomos de oxígeno en los reactivos? Multiplicando por 2 el agua:
H2 + O2 → 2H2O
Ahora tenemos los oxígenos ajustados, pero no los hidrógenos. En los reactivos tenemos 2 hidrógenos, en los productos tenemos 4. ¿Cómo hacemos para poner 2 hidrógenos más en los reactivos? Pues mulltiplicando el H2 por 2:
2H2 + O2 → 2H2O
Listo, ahora sí se cumple la Ley de Lavoisier.
(c) Ajústala por el método algebraico
Al ser tan fácil en este caso, vamos a buscar un ejemplo más difícil, como este:
FeS2 → Fe3S4 + S2
El primer paso de este método es asignar a cada reactivo y producto una letra, por ejemplo:
A = FeS2
B = Fe3S4
C = S2
Ahora vamos elemento a elemento. En este caso tenemos dos elementos distintos: el hierro y el azufre.
HIERRO 1A = 3B
AZUFRE 2A = 4B + 2C
Vamos indicando cuántos átomos de cada elemento hay en cada reactivo o producto.
Y el siguiente paso es asignar un valor a la letra que queramos, siempre buscando no complicarnos la vida. Por ejemplo, B = 1.
Luego A = 3B = 3·1 = 3
Despejamos C de la ecuación del azufre, C = (2A - 4B)/2 = A - 2B = 3 - 2·1 = 1
Nos queda, A = 3, B = 1, C = 1. Así que:
3FeS2 → Fe3S4 + S2
Vemos como ahora está ajustada:
REACTIVOS: 3 hierro y 6 azufre
PRODUCTOS: 3 hierro y 6 azufre
ALGUNOS EJERCICIOS PARA PRACTICAR

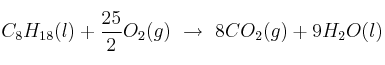
No hay comentarios:
Publicar un comentario